
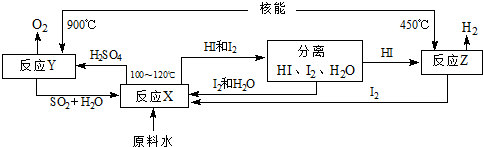
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}
 ��1����֪A��B���������Ԫ�أ���ԭ�ӵĵ�һ��������x�����1��ʾ��
��1����֪A��B���������Ԫ�أ���ԭ�ӵĵ�һ��������x�����1��ʾ��| ��x��/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| ���r(ji��)�I | C-C | C-N | C-S |
| �I��/kJ•mol-1 | 347 | 305 | 259 |
| �x�Ӿ��w | NaCl | KCl | CaO |
| �����ܣ�kJ•mol-1�� | 786 | 715 | 3401 |
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}
 +2KMnO4$\stackrel{��}{��}$
+2KMnO4$\stackrel{��}{��}$ +2MnO2��+1H2O+��1��KOH
+2MnO2��+1H2O+��1��KOH �cC��1��1���ɸ߷��ӻ�����ķ���(y��ng)����ʽ��
�cC��1��1���ɸ߷��ӻ�����ķ���(y��ng)����ʽ��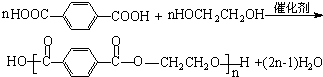 ��
���鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ��x���}
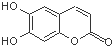 �в�ˎ��Ƥ�к��е����~��(sh��)��(n��i)�������п������ã���1mol���~��(sh��)��(n��i)���քe�c����ˮ��NaOH��Һ��ȫ����(y��ng)���t���ĵ�Br2��NaOH�����|(zh��)�����քe�飨������
�в�ˎ��Ƥ�к��е����~��(sh��)��(n��i)�������п������ã���1mol���~��(sh��)��(n��i)���քe�c����ˮ��NaOH��Һ��ȫ����(y��ng)���t���ĵ�Br2��NaOH�����|(zh��)�����քe�飨������| A�� | 2 mol Br2 2 mol NaOH | B�� | 2 mol Br2 3 mol NaOH | ||
| C�� | 3 mol Br2 4 mol NaOH | D�� | 4 mol Br2 4 mol NaOH |
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}

| �ض�/�� | 400 | 500 | 600 |
| SO2�D(zhu��n)����/% | 99.2 | 93.5 | 73.7 |
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ��x���}
| A�� | H2O��g���TH2��g��+$\frac{1}{2}$O2��g����H=-485 kJ•mol-1 | B�� | H2O��g���TH2��g��+$\frac{1}{2}$O2��g����H=485 kJ•mol-1 | ||
| C�� | 2H2��g��+O2��g���T2H2O��g����H=485 kJ•mol-1 | D�� | 2H2��g��+O2��g���T2H2O��g����H=-485 kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ��x���}
| A�� | 3NO2+H2�T2HNO3+NO | B�� | 4FeS2+11O2$\frac{\underline{\;\;��\;\;}}{\;}$2Fe2O3+8SO2 | ||
| C�� | 3Cl2+8NH3�TN2+6NH4Cl | D�� | 2Na+2NH3��Һ���T2NaNH2+H2 |
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ��x���}
| A�� | CaCO3 | B�� | Na2SO3 | C�� | H2SO4 | D�� | Ca��OH��2 |
�鿴�𰸺ͽ���>>
��Ŀ�� ��(l��i)Դ�� �}�ͣ���(sh��)�(y��n)�}
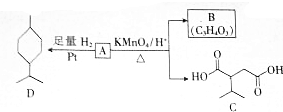
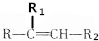 $��_{��}^{KMnO_{4}/H+}$
$��_{��}^{KMnO_{4}/H+}$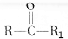 +R2COOH
+R2COOH ��A�c�����|(zh��)����������|(zh��)����(y��ng)�Įa(ch��n)����3�N��
��A�c�����|(zh��)����������|(zh��)����(y��ng)�Įa(ch��n)����3�N�� +H2$\stackrel{����}{��}$
+H2$\stackrel{����}{��}$ ��
���鿴�𰸺ͽ���>>
�ٶ����� - ����(x��)��(c��)�б� - ԇ�}�б�
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��(b��o)ƽ�_(t��i) | �W(w��ng)���к���Ϣ�e��(b��o)��(zhu��n)�^(q��) | ����p�_�e��(b��o)��(zhu��n)�^(q��) | ��vʷ̓�o(w��)���x�к���Ϣ�e��(b��o)��(zhu��n)�^(q��) | �����֙�(qu��n)�e��(b��o)��(zhu��n)�^(q��)
�`���Ͳ�����Ϣ�e��(b��o)�Ԓ��027-86699610 �e��(b��o)�]�䣺58377363@163.com