
題目列表(包括答案和解析)
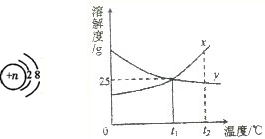 (1)在非金屬單質中,活潑性強的非金屬可以把活潑性弱的非金屬從溶液中置換出來.例如:Cl2+2NaBr=Br2+2NaCl Br2+2NaI=I2+2NaBr I2+Na2S=S↓+2NaI Cl2+2NaI=I2+2NaCl
(1)在非金屬單質中,活潑性強的非金屬可以把活潑性弱的非金屬從溶液中置換出來.例如:Cl2+2NaBr=Br2+2NaCl Br2+2NaI=I2+2NaBr I2+Na2S=S↓+2NaI Cl2+2NaI=I2+2NaCl
| ||
| ||
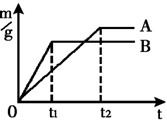
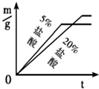 B.
B. C.
C.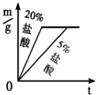 D.
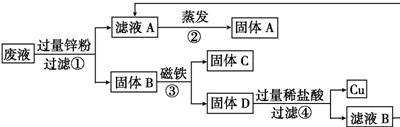
D.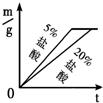
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com