
題目列表(包括答案和解析)
下列表示物質(zhì)變化的化學(xué)用語正確的是
A. 已知在298K時下述反應(yīng)的有關(guān)數(shù)據(jù):
C(s) + 1/2 O2(g) = CO(g) △H1 =-110.5 kJ·mol-1
C(s) + O2(g) = CO2(g) △H2=-393.5 kJ·mol-1,
則C(s)+CO2(g)== 2CO(g) △H=-172.5 kJ·mol-1
B. KI溶液中滴加過量氯水發(fā)生反應(yīng)的離子方程式為3Cl2+I-+3H2O ====6H++IO3-+6Cl-
C. 等物質(zhì)的量的NH4HCO3與Ba(OH)2 溶液混合反應(yīng)的離子方程式為Ba2++HCO3-+OH-=BaCO3↓+H2O
D. 用銅作電極電解硫酸溶液: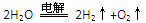
下列表示物質(zhì)變化的化學(xué)用語中,正確的是( )
A.堿性氫氧燃料電池的負(fù)極反應(yīng)式為O2+2H2O+4e- 4OH-
4OH-
B.用惰性電極電解飽和食鹽水時,陽極的電極反應(yīng)式為2Cl--2e- Cl2↑
Cl2↑
C.表示乙炔燃燒熱的熱化學(xué)方程式:C2H2(g)+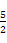 O2(g)
O2(g) 2CO2(g)+H2O(g) ΔH=-1 256 kJ/mol
2CO2(g)+H2O(g) ΔH=-1 256 kJ/mol
D.M與N互為同素異形體,由M N ΔH=+119 kJ/mol可知,N比M穩(wěn)定
N ΔH=+119 kJ/mol可知,N比M穩(wěn)定
A.堿性氫氧燃料電池的負(fù)極反應(yīng)式為O2+2H2O+4e- 4OH- 4OH- |
B.用惰性電極電解飽和食鹽水時,陽極的電極反應(yīng)式為2Cl--2e- Cl2↑ Cl2↑ |
C.表示乙炔燃燒熱的熱化學(xué)方程式:C2H2(g)+ O2(g) O2(g) 2CO2(g)+H2O(g) ΔH="-1" 256 kJ/mol 2CO2(g)+H2O(g) ΔH="-1" 256 kJ/mol |
D.M與N互為同素異形體,由M NΔH="+119" kJ/mol可知,N比M穩(wěn)定 NΔH="+119" kJ/mol可知,N比M穩(wěn)定 |
| A.已知在298K時下述反應(yīng)的有關(guān)數(shù)據(jù): C(s) + 1/2 O2(g) =" CO(g)" △H1 =-110.5 kJ·mol-1 C(s) + O2(g) = CO2(g) △H2=-393.5 kJ·mol-1, 則C(s)+CO2(g)="=" 2CO(g)△H=-172.5 kJ·mol-1 |
| B.KI溶液中滴加過量氯水發(fā)生反應(yīng)的離子方程式為3Cl2+I-+3H2O ====6H++IO3-+6Cl- |
| C.等物質(zhì)的量的NH4HCO3與Ba(OH)2溶液混合反應(yīng)的離子方程式為Ba2++HCO3-+OH-=BaCO3↓+H2O |
D.用銅作電極電解硫酸溶液: |
 H2S+OH-
H2S+OH- 湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com