
科目: 來(lái)源: 題型:
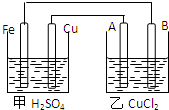 據(jù)圖回答以下問(wèn)題:
據(jù)圖回答以下問(wèn)題:查看答案和解析>>
科目: 來(lái)源: 題型:
查看答案和解析>>
科目: 來(lái)源: 題型:
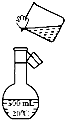 某同學(xué)用固體NaOH配制1000mL 0.40mol/L的NaOH溶液,回答下列問(wèn)題:
某同學(xué)用固體NaOH配制1000mL 0.40mol/L的NaOH溶液,回答下列問(wèn)題:查看答案和解析>>
科目: 來(lái)源: 題型:
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半徑(10-10m) | 0.74 | 1.60 | 0.53 | 1.10 | 0.99 | 1.11 | 0.75 | 1.43 |
| 最高或最低化合價(jià) | +2 | +1 | +5 | +7 | +2 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
查看答案和解析>>
科目: 來(lái)源: 題型:
查看答案和解析>>
科目: 來(lái)源: 題型:
| 實(shí)驗(yàn) 混合溶液 |
A | B | C | D | E | F |
| 4mol?L-1H2SO4溶液/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 飽和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目: 來(lái)源: 題型:
查看答案和解析>>
科目: 來(lái)源: 題型:
查看答案和解析>>
科目: 來(lái)源: 題型:
查看答案和解析>>
科目: 來(lái)源: 題型:
查看答案和解析>>
百度致信 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com