
��Ŀ�� ��Դ�� �}�ͣ�����}
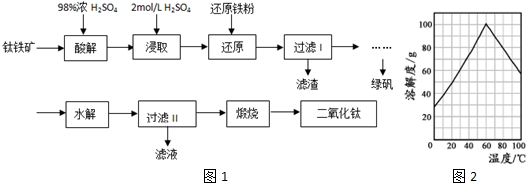
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
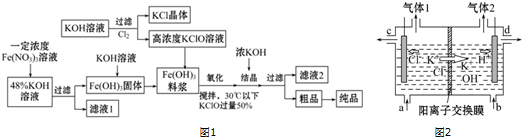
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}

�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
| �����x�� | �_ʼ������pH | ������ȫ��pH |
| Fe3+ | 1.9 | 3.2 |
| Zn2+ | 5.2 | 6.4 |
| Fe2+ | 5.8 | 9.7 |
 ��������ĽY(ji��)��(g��u)��ʽ��
��������ĽY(ji��)��(g��u)��ʽ�� ��
���鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
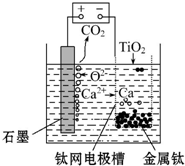
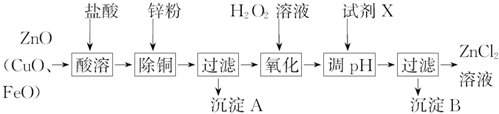
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
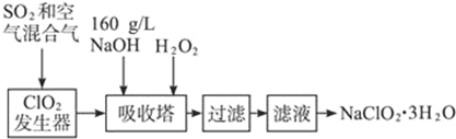
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
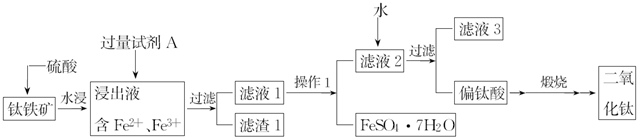
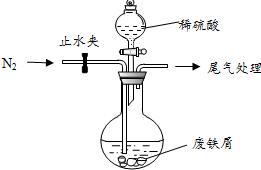 �G�\��FeSO4•7H2O�����ί�ȱ�F��ؚѪ����Чˎ��ij���W(xu��)�dȤС�M���G�\�M(j��n)�������µ�̽����
�G�\��FeSO4•7H2O�����ί�ȱ�F��ؚѪ����Чˎ��ij���W(xu��)�dȤС�M���G�\�M(j��n)�������µ�̽�����鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
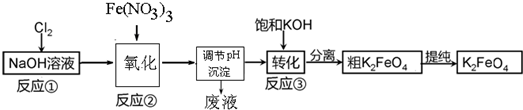

�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��x���}
| A�� | HNO3�������� | |
| B�� | ��������߀ԭ�������|(zh��)����֮�Ȟ�1��1 | |
| C�� | ��(d��ng)����1molI2�r���D(zhu��n)��2mol��� | |
| D�� | ��ԓ����(y��ng)��֪߀ԭ�ԣ�Se��KI |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�Ӌ���}
�鿴�𰸺ͽ���>>
�ٶ����� - ����(x��)���б� - ԇ�}�б�
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��ƽ�_ | �W(w��ng)���к���Ϣ�e�^(q��) | ����p�_�e�^(q��) | ��vʷ̓�o���x�к���Ϣ�e�^(q��) | �����֙�(qu��n)�e�^(q��)
�`���Ͳ�����Ϣ�e���Ԓ��027-86699610 �e���]�䣺58377363@163.com